Quote:
Originariamente inviata da DNAnna
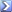
NaOH è una base forte:
NaOH -> Na+ + OH-
quindi calcoliamo le moli di NaOH e saranno uguali alle moli di OH-:
moli NaOH= 0.5102 / 40 =0.013 moli
Moli OH- = 0.013
Ora calcoliamo le moli di OH- contenute in 373 g di H2O:
moli OH- = 373/18=20.7 moli
Frazione molare OH-= moli soluto/moli soluto+ moli sovente
Frazione molare OH-= 0.013/0.013+20.7 = 6.2 * 10^-4
Per quanto riguarda il calcolo scritto sul tuo libro, l'unica spiegazione che posso darti è questa:
molto probabilmente il libro fa prima il calcolo riferendosi ad 1 Kg di H2O e quindi 1000 g di H2O.
Calcola le moli presenti in 1000 g di H2O: 1000 /18= 55.5
Poi imposta la seguente proporzione:
55.5 moli di H2O: 1000 g di H2O = X moli H2O : 373 g di H2O
Da cui:
moli di OH- contenute in 373 g di H2O= 373 * 55.5 / 1000= 20.7
|
Ok credo di aver capito! Grazie milleeeee!!!!:)