Quote:
Originariamente inviata da Taty93
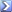
1,7 L di di NH3 gassosa, alla pressione di 1atm e alla temperatura di 25°C, vengono disciolti in 2,0 litri di soluzione acquosa 0.02 M di HCl. Calcolare il pH della soluzione acquosa risultante sapendo che per NH3 la Kb= 1,8x10^-5
non so proprio da dove cominciare..potete aiutarmi? grazie mille
|
Con l'equazione di stato dei gas perfetti...puoi ricavarti le moli di ammonica che sono disciolte nella soluzione di acido..
a questo punto...ammoniaca ed acido cloridrico reagisocno secondo l'equazione:
NH3 + HCl -> NH4+ + Cl-
L'ammoniaca è una base debole. Quando una base debole reagisce con un acido forte, si può formare un tampone (in base alla quantità).
Con i dovuti calcoli, verifica quanto NH4 si forma e quanta ammoniaca avanza alla fine della reazione