Quote:
Originariamente inviata da zicchinet
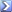
L' Acido Ascorbico (vitaminaC) reagisce con I3- formando l'acido deidroascorbico. Nella reazione č utilizzato come indicatore l'amido. Il punto finale č contrassegnato dalla scomparsa di un complesso amido-iodio blu scuro quando la prima goccia di I3- non reagito rimane in soluzione.
A) Se per reagire con 0,1970g di A.ascorbico puro sono necessari 29,41 mL di una soluzione I3-, qual'č la della soluzione I3-?
B) Una compressa di vitamina C contenente acido ascorbico pił un legante inerte č stata macinata e ridotta in polvere, e se ne sono titolati 0,4242g con 31,63 mL di I3-, trovare la percentuale in peso di acido ascorbico nella compressa.
|
Soluzioni:
A) 0.076N. (Immagino si voglia conoscere la normalitį del titolante, dato che non é scritto nel problema.
Esecuzione: i grammi di Ac. Ascorbico diviso il suo peso equivalente (che corrisponde al suo peso molecolare diviso 2), consente di ottenere gli equivalenti di Acido Ascorbico che hanno reagito. Tali equivalenti corrispondono agli equivalenti di I3-. Moltiplicando per 1000 si ottengono i meq di I3-. I meq di I3- diviso i mL di I3- utilizzati nella titolazione danno la N del I3-
B) 49,9%.
Esecuzione: i mL di I3- util;izzati nella reazione per la Noprmalitį dellI3- danno i meq che hanno reagito, questi corrispondono ai meq di Ac.Ascoebico. I meq di Ac. Ascorbico moltiplicati per il suo PE danno i mg di Ac. Ascorbico nel campione. Per trovarne la %, si dividono tali mg per il peso della compressa e si moltiplica per 100.