Quote:
Originariamente inviata da zicchinet
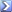
I cloruri contenuti in un campione sono stato precipitati come AgCl aggiungendo 56,00 mL di AgNO 3 0.0200 M . L'eccesso di Ag + è stato poi retrotitolato con 8.86 mL di KSCN 0.0400 M . Calcolare i grammi di Cl - presenti nel campione, espressi come NaCl.
|
Si è messo dell'AgNO3 in quantità nota in un recipiente. Una parte di questo composto (che si è dissociato in ioni Ag+ e NO3-) ha reagito con i cloruri del nostro CAMPIONE (ed è precipitato come AgCl); un'latra parte è rismasto in soluzione.
-Calcoliamo la quantità di Ag+ che è presente inizialmente, cioè che deriva dall' AgNO3 (ricorda che il V va espresso in litri):
n= M x V = 0,00200 x 0,056
Chiamiamo queste "moli iniziali di Ag+)
-Altro Ag+ resta in soluzione, è dunque in eccesso; reagirà TUTTO con KSCN.
Le moli di KSCN che reagiscon con l'Ag+ in eccesso, sono:
n= MxV = 0,0400 x 0,00886
E' ovvio quindi che queste siano anche le moli dell'Ag+ in eccesso!
Chiamiamole "moli in eccesso di Ag+"
-A questo punto, serve una semplice sottrazione per conoscere l'Ag+ che ha reagito con i cloruri:
n (di Ag+) = (moli iniziali di Ag+) - (moli in eccesso di Ag+)
Questa quantità di Ag+ ha reagito con i cloruri, dunque corrisponde esattamente anche alla quantità dei cloruri!!
-Per conoscere, infine, i grammi di Cl-, poichè NON ESISTE il peso molecolare di uno ione, occorre sfruttare un composto chimico (in questo caso NaCl):
g= n (di Ag+) x PM (di NaCL).
In bocca al lupo!
Dott.ssa Raffaella Russo