Quote:
Originariamente inviata da zicchinet
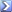
Un'aliquota da 25,00mL di una soluzione contenente lo ione Tl (I) è stata trattata con K 2 CrO 4 . Il Tl 2 CrO 4 è stato filtrato, liberato mediante lavaggio dall'eccesso di agente di precipitazione e disciolto in H 2 SO 4 diluito. Il Cr 2 O 7 2- prodotto è stato titolato con 39,52mL di una soluzione di Fe 2+ 0,1044M. Qual'era la massa di Tl nel campione?
|
Ciao Zicchinet!
I problemi che ci proponi, hanno più o meno tutti lo stesso tipo di impostazione: occorre partire dalla parte finale per giungere alla soluzione.
-Si calcola la quantità in moli di Fe++ che sta reagendo con lo ione dicromato Cr2O7-- (ricorda che il volume va espresso in litri!):
n= MxV = 0,1044 x 0,3952
-Poichè Fe++ e lo ione dicromato reagiscono in rapporti di 1:1, le moli di Fe++ sono uguali a quelle dello ione dicromato.
-Nella soluzione dove si è formato il dicromato, era stata inserita una quantità di Tl2CrO4--.
Quest'ultimo dunque, è nella stessa quantità del dicromato, parlando in moli.
Poichè è un sale totalmente solubile, anche gli ioni da esso derivati saranno nella stessa quantità!
Quindi:
n CrO4-- = n Tl2CrO4 = n Cr2O7--
-Le moli di ioni Tl (tallio), derivano dalla seguente dissociazione:
Tl2CrO4 --> 2 Tl+
+ CrO4--
quindi le moli di tallio sono il doppiorispetto alle moli di CrO4--
n(Tl) = 2 x n CrO4--
-Per calcolare i grammi:
g = n(Tl) x Peso Molecolare (Tl2CrO4)