Quote:
Originariamente inviata da string
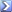
Per titolare 40 m di una soluzione di acido ortofosforico, sono necessari 120 ml di una soluzione 0,531 N di NaOH. Determinare la normalità della soluzione di acido ortofosforico. [R = 1,59 N]
|
Nella traccia c'è un errore di trascrizione, ma suppongo che quei
40 m in realtà siano
40 ml..
Se così non fosse, nell'esercizio originario, fammi sapere.
Comunque provo a risolverlo lo stesso.
La Normalità N, è in rapporto con la Molarità M,nella seguente maniera:
N = M x
Valenza operativa
La
valenza operativa è rappresentata dal numero degli
OH per le basi, e dal numero degli
H per gli acidi.
Quindi, per l'idrossido di sodio si ha:
M = N/1 = 0,531/1 = 0,531
Poichè si tratta di una titolazione acido-base, è vera l'equivalenza qui di seguito riportata:
Ma x Va = Mb X
Vb
Dove con M si intende la Molarità e con V il volume; e (a) e (b) sono rispettivamente l'acido e la base.
La Molarità dell'acido, si calcola con la formula inversa:
Ma= Mb x
Vb / Va
(i volumi vanno espressi in litri!)
Sostituendo i valori, si ha:
Ma = 0,531 x = 0,040 / 0,040 = 0,531
La Normalità dell'acido, si calcola:
N = M X Valenza Operativa = 0,531 X 3 = 1,59
In bocca al lupo, ciao!
Violetta
Quote:
Originariamente inviata da Violetta
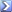
Nella traccia c'è un errore di trascrizione, ma suppongo che quei 40 m in realtà siano 40 ml..
Se così non fosse, nell'esercizio originario, fammi sapere.
Comunque provo a risolverlo lo stesso.
La Normalità N, è in rapporto con la Molarità M,nella seguente maniera:
N = M x Valenza operativa
La valenza operativa è rappresentata dal numero degli OH per le basi, e dal numero degli H per gli acidi.
Quindi, per l'idrossido di sodio si ha:
M = N/1 = 0,531/1 = 0,531
Poichè si tratta di una titolazione acido-base, è vera l'equivalenza qui di seguito riportata:
Ma x Va = Mb X Vb
Dove con M si intende la Molarità e con V il volume; e (a) e (b) sono rispettivamente l'acido e la base.
La Molarità dell'acido, si calcola con la formula inversa:
Ma= Mb x Vb / Va
(i volumi vanno espressi in litri!)
Sostituendo i valori, si ha:
Ma = 0,531 x = 0,040 / 0,040 = 0,531
La Normalità dell'acido, si calcola:
N = M X Valenza Operativa = 0,531 X 3 = 1,59
In bocca al lupo, ciao!
Violetta |
N.B. Nel calcolo della Normalità dell'acido, la molarità è stata moltiplicata per 3 perchè la formula chimica dell'acido ortofosforico è H3PO4, e dunque questo tipo di acido perde 3 H+