Quote:
Originariamente inviata da string
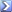
Qual è il pH del punto equivalente quando 100 ml di acido idrossiaceitico 0,100 M viene titolato con KOH 0,05M (Ka 1,48×10-4) [R = 8,18]
|
Una reazione in cui un acido e una base, reagendo tra loro, danno luogo a un sale e acqua è una reazione di salificazione o neutralizzazione. Nelle titolazioni acido- base la procedura prevede, leggendo la buretta, l'ottenimento del volume di reagente in grado di neutralizzare l'analita.
La reazione può scriversi come segue:
acido HA + base BOH = sale BA + acqua.
-Per fare la neutralizzazione, occorrono le moli, in quanto la formula è:
moli di base - moli di acido= moli che restano in soluzione
Per calcolare le moli di acido (esprimere il Volume in litri):
n= M X V = 0,100 x 0,100 = 0,0100
Per calcolare le moli della base:
n= M X V = 0,5 x 0,100 = 0,05
Ora si può fare la neutralizzazione:
resteranno in soluzione 0,04 moli di base.
-Poichè si lavora con una base, si deve ottenere la Kb (invece la traccia fornisce una Ka). Quindi:
Kb = Kw - Ka
(dove Kw è la costante di ionizzazione dell'acqua e vale 1,0 X 10 -14)
e si ottiene un certo valore di Kb.
-Per il calcolo del pH, occorre dissociare la base, e poichè a questo punto è nota la Kb, si determina il valore dell'incognita (che corrisponde alla concentrazione degli ioni OH-)
P.S: se occorrono ulteriori spiegazioni su questa parte del calcolo del pH, fatti sentire!!
- Continuando il nostro esercizio, nota la concentrazione di OH-, si determina il pOH facendo il logaritmo negativo di tale valore.
-Poichè la traccia richiede un valore di pH, alla fine si effettuerà il seguente calcolo:
pH= 14- pOH
Non ho la calcolatrice adatta, e non posso fare calcoli.
Fammi sapere!
In bocca al lupo!
Violetta