Quote:
Originariamente inviata da pulcino
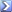
Calcolare il pH di una soluzione di bicarbonato di sodio 0,2 M spiegando il procedimento adottato e le eventuali semplificazioni. K’a = 1,6·10-7 K”a = 7,9·10-13
|
1) Tieni presente che HCO3- in soluzione può agire sia da acido che da base. Pertanto è possibile scrivere le due reazioni e trasformarle in un'unica reazione; sarà con quest'ultima che si procederà col calcolo del pH:
HCO3- + H2O --> CO3- - + H3O+ acido
HCO3- + H2O --> H2CO3 + OH- base
——————————————————
2 HCO3- + (H2O) --> CO3- - + H2CO3 reazione totale
2)Applicando la legge di azione di massa al I e al II equilibrio scritto sopra abbiamo:
[CO3- -] ·[H3O+] / [HCO3-] = Ki = K”a (I)
[H2CO3] ·[OH-] /[HCO3-] = K”i = Kb = Kw/ K'a
Dalla I si ottiene:
[HCO3-] = [CO3- -]·[H3O+] / K"a
Dalla II si ottiene:
[HCO3-] = [H2CO3]·[OH-]· K’a /Kw
Uguagliando le due equazioni scritte sopra si ricava:
[CO3- -]·[H3O+] /K"a = [H2CO3]·[OH-]· K’a /Kw
Si ricava la quantità di H3O+ da questa uguaglianza:
[H3O+] = (K”a· K ‘a /Kw) x ([H2CO3] / [CO3- -]) x [OH-]
H2CO3 e CO3- - sono alla stessa concentrazione, per cui il rapporto vale 1.
Inoltre, essendo
Kw = [H3O+] · [OH-]
sarà: [OH-] = Kw/[H3O+].
E quindi:
[H3O+] = (K’a· K”a /Kw) x (Kw/[H3O+])
da cui
[H3O+]2 = K’a· K”a
[H3O+] = radice quadrata [H3O+] = radice quadrata di (1,6 ·10-7 · 7,9 ·10-13)
[H3O+] = 3,56 ·10-10
e quindi pH = 9,45
(N.B per questa tipologia di esercizi, non è necessaria la concentrazione iniziale del sale)
-------------------------------------------------------------------------
Lo stesso esercizio, può essere svolto adottando delle semplificazioni (come qui di seguito ti mostrerò). Il pH avrà un valore leggermente diverso:
Tieni presente che NaHCO3 è un sale che in soluzione risulta completamente dissociato. Lo ione HCO3- è presente in concentrazione 0,2 moli/litro e può reagire, come detto precedentemente, sia da acido sia da base.
L’acido HCO3- è un acido debolissimo, infatti la costante di acidità K”a ha un valore piccolissimo per cui il suo contributo in ioni H+ lo possiamo ritenere irrilevante
(questa è la semplificazione che potresti adottare!)
Se invece consideriamo HCO3- come la base coniugata dell’acido H2CO3 anche essa sarà una base debole ma tuttavia con una forza paragonabile a quella del suo acido coniugato infatti la sua Kb può essere ricavata dal valore di K’a nel modo seguente:
Kb = Kw/K’a --> Kb = 10-14/1,6·10-7 --> Kb = 6,25·10-8.
Per quanto debole la base darà idrolisi:
HCO3- + H2 O --> H2CO3 + OH-
Applicando la legge di azione di massa si avrà:
[H2CO3] · [OH-] /[HCO3-] = Ki = Kb = Kw/K'a= 6,25·10-8
Indicando con X le concentrazioni molari all’equilibrio sia di H2CO3 che di OH- che in quel momento sono uguali, la concentrazione di HCO3- sarà ridotta a 0,2 - X:
X2 / o,2-x = 6,25·10-8.
Trascurando la X a denominatore avremo:
X2 = 1,25·10-8 --> X = 1,12·10-4
[OH-] = 1,12·10-4
quindi pOH = 3,95
quindi
pH = 10,05
(Come puoi notare, con delle semplificazioni il valore del pH esce leggermente diverso)
(rifai i calcoli, comunque.... anche se penso di non aver trascurato nulla)
Violetta