Quote:
Originariamente inviata da pulcino
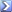
Calcolare il pH di una soluzione di bicarbonato di sodio 0,2 M spiegando il procedimento adottato e le eventuali semplificazioni. K’a = 1,6·10-7 K”a = 7,9·10-13
|
per il calcolo del pH di soluzioni di sali acidi (tipo NaHA), con tutte le approssimazioni del caso,
non è necessario cooscere la concentrazione iniziale del sale ,poichè il pH dipende solo dalle Ka dell'acido da cui deriva, secondo la seguente formula:
[H+] = raducqQuadratadi(Ka1*Ka2) = (1.6*10^-7 * 7.9*10^-13)^1/2 = 3.6*10^-10
=> pH = 9.45
__________________
Lezioni e svolgimento di esercizi di CHIMICA on line!
http://chimicaonline.xoom.it
Sono anche su facebook, ID: Lachimica On Line
