Quote:
Originariamente inviata da string
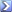
Calcolare il volume di HCl 0,06122 M necessario per titolare
a) 20 ml di Na3PO4 0,05555 M al punto finale della timolftaleina [R =18,15;]
|
L’indicatore timolftaleina ha un intervallo di viraggio compreso tra pH = 9,3 e pH = 10,5.Alla soluzione è aggiunta una base forte ( tra parentesi, l'indicatore assume la colorazione blu).
Il volume di acido cloridrico (HCl) che si vuol calcolare, corrisponde a un numero di moli pari alle moli del fosfato trisodico (Na3PO4).
Dunque per prima cosa si determinao le moli del fosfato (col Volume espresso in litri):
n= MxV= 0,05555 x 0,02 = 0,001111
A questo punto, si può determinare il volume dell'acido (dato che è nota la molarità dell'acido stesso):
V= n/M = 0'001111/0,06122 = 0,01815 litri = 18,15 ml
In bocca al lupo!
Violetta



 Discussioni simili
Discussioni simili